Холестерин VS Статины. Часть1
Я – Ян Викторович Кимаковский, врач-терапевт и эндокринолог по образованию, автор книг «АИТ и гипотиреоз. Нюансы решают всё!», «Повышенный холестерин. Профилактика и лечение атеросклероза», «Инсулинорезистентность. Полные сведения о состоянии и его устранении». На данный момент работаю на стыке доказательного и превентивного направления как специалист интегративной медицины, нутриционист с 2015 года.

Содержание
Содержание
Высокая распространённость сердечно-сосудистых заболеваний привела к тому, что многие врачи второй половины 20-го столетия стали говорить о так называемой “эпидемии” этих болезней. Нельзя сказать, что в 21-ом веке ситуация стала лучше. Сердечно-сосудистые заболевания, из которых более чем ⅔ составляют: ишемическая болезнь сердца (ИБС), инфаркт миокарда, ишемический инсульт, болезни периферических артерий, напрямую связаны с атеросклерозом и являются ведущей причиной смертности во всём мире.
Атеросклероз широко распространён среди населения как экономически развитых стран, так и среди населения стран развивающихся (но упоминать об этом обычно не принято, дочитав эту статью до конца, вы узнаете – почему). В Европе и Северной Америке, ассоциированные с атеросклерозом патологии сердечно-сосудистой системы твёрдо вышли на первое место среди причин смертности и продолжают удерживаться в “лидерах”. Во второй половине 20-го века заболевание стало быстро охватывать географические зоны, в которых раньше не встречалось – Япония, Китай и некоторые страны Африки.
Россия занимает одно из первых мест среди развитых стран по смертности от сердечно-сосудистых заболеваний. Начиная с середины 1960-х годов этот показатель продолжает неуклонно расти. В Российской Федерации от сердечно-сосудистых заболеваний происходит до 57% летальных исходов. Большинство из них связаны с болезнями, обусловленными атеросклерозом.
Сегодня двое из трёх мужчин в России умирают от последствий атеросклеротических заболеваний сердца и сосудов. Согласно статистике ВОЗ, от заболеваний органов кровообращения в мире умирает более 16 млн человек ежегодно. Это количество сопоставимо с количеством погибших в результате военного конфликта. Несмотря на множество значительных достижений современной медицины, преимущество в “войне” с данной патологией пока не на стороне человечества и это заставляет задуматься: а правильные ли выбраны стратегии, если ситуация только усугубляется?

ХОЛЕСТЕРИН – что это?
В повседневном обиходном восприятии большего числа людей и иногда даже врачей, существует негласное правило: ставить знак равенства между понятиями “высокий холестерин”, “атеросклероз” и “инфаркт/инсульт”. И если инфаркты и инсульты действительно происходят вследствие атеросклеротического поражения соответствующих сосудов, то понятие “повышенный холестерин” далеко не всегда напрямую связано с рисками. Вокруг холестерина ситуация сложилась странная. Часто цитируются весьма устаревшие медицинские постулаты и тиражируются выводы, основанные на ошибках интерпретации, а иногда откровенная реклама со стороны заинтересованных лиц. Причины и следствия оказываются поменяны местами и люди получаются с одной стороны запуганы, а с другой стороны лишены возможности расставить для себя все точки над “i”.
Самое поразительное, что и врачи зачастую оказываются во власти мифов и заблуждений, а борьба с сердечно-сосудистыми заболеваниями превращается в нечто похожее на то, как слепой пытается вести слепого. Чтобы немного сдвинуться с мёртвой точки, для начала разберёмся, что же такое холестерин.
Холестерин/холестерол – это органическое соединение, природный полициклический липофильный спирт, который содержится в мембранах клеток человека и животных.
Данное соединение полностью отсутствует в клеточных мембранах растений и грибов. Поэтому ни один растительный продукт не может содержать холестерина. Холестерин нерастворим в воде, но растворим в жирах и органических растворителях. Легко синтезируется в организме из жиров, глюкозы и даже аминокислот.
Почему холестерин важен?
В сутки образуется до 2,5 г холестерина, тогда как с пищей может поступить лишь 0,3 – 0,5 грамма. Холестерин обеспечивает устойчивость мембран наших клеток к окружающей температуре, благодаря ему мы можем переносить её колебания. Подобно кирпичикам в толще стен здания, холестерин вместе с фосфолипидами обеспечивает клеткам определённую устойчивость.
Он также необходим для синтеза витамина Д и гормонов стероидного ряда – половые гормоны: эстрогены, прогестерон, тестостерон; надпочечниковые: кортизол, альдостерон.
Поэтому диета, ограничивающая поступление холестерина, может быть вредна для мужского здоровья. Важен для синтеза желчных кислот. Обеспечивает защиту эритроцитов от ядов, приводящих к их преждевременной гибели.
Соблюдение бесхолестериновой диеты здоровыми женщинами детородного возраста полностью бессмысленно, поскольку до наступления климакса женские половые гормоны защищают стенки сосудов и не позволяют холестерину откладываться на них.
Если же женщина страдает тем или иным гормональным дисбалансом, то такая диета может привести к прекращению менструаций. Сильное ограничение жирных продуктов, обезжиренная диета – все эти веяния чреваты значительным снижением выработки эстрадиола в лютеиновой фазе менструального цикла, а это может приводить к гормональному бесплодию.
Более того, именно у таких женщин в фолликулярной фазе менструального цикла отмечается повышение уровня липопротеинов очень низкой плотности (ЛПоНП) и триглицеридов. А именно такие изменения липидограммы могут вести к атеросклерозу, а при уже имеющемся атеросклерозе – к его прогрессированию.
Синтез пролактина и соматотропина, необходимых для лактации, у женщин, потребляющих богатую жирами пищу, на 28 % выше, чем у женщин соблюдающих обезжиренную диету. Если Вы кормящая мама или планируете ею стать в будущем, не стоит игнорировать этот важный момент.
Также важен холестерин и для нашей ЦНС. Например, для нормальной деятельности серотониновых (1А) рецепторов в головном мозге и для правильной работы адренергических рецепторов в нём же (мозге). Активность серотониновых рецепторов ослабляется пропорционально уменьшению содержания холестерина в мембранах клеток гиппокампа.
Серотонин в обиходе часто называют “гормоном счастья” или “гормоном хорошего настроения” (что не совсем верно, в отличие от дофамина и эндорфинов он не делает нас счастливее, но его функция в том, чтобы помогает смягчить удары судьбы и благодаря ему мы не воспринимали каждую передрягу как катастрофу). Низкий уровень холестерина ассоциирован с агрессивностью, депрессией и суицидальными наклонностями. Наиболее выражено такое влияние у людей преклонного возраста.
Как видим, у холестерина есть вполне полезные функции и их не так уж мало.
Благодаря навязанным различной рекламой стереотипам, часто случается так, что холестерин путают с жирами. Но дело в том, что в отличие от жиров, он не используется организмом для получения энергии, и абсолютно не имеет никакого отношения к ожирению, тучности. Есть масса лиц с лишним весом и нормальным уровнем холестерина. Есть масса лиц с нормальной и даже недостаточной массой тела (!!!) и при этом имеющих запредельно высокий холестерин. Поэтому фразы из серии “я стройный (-ая), значит холестерин у меня в норме” – заблуждение.
Гиперхолестеринемия
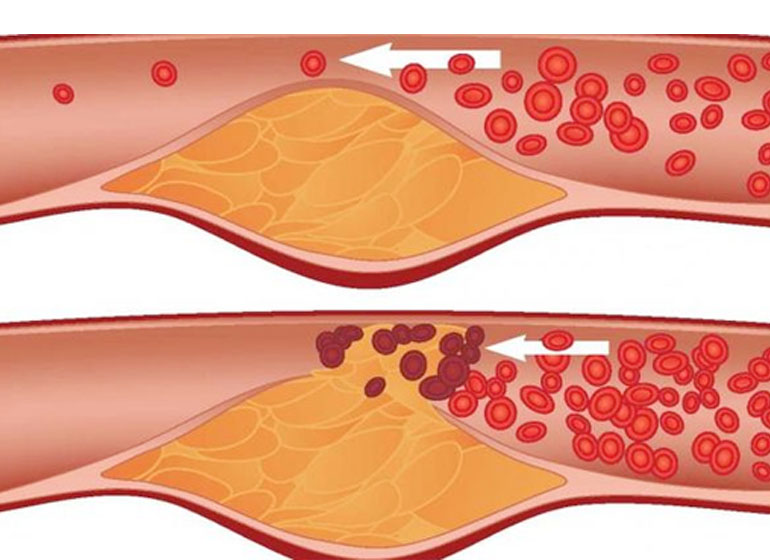
Гиперхолестеринемия или по другому, повышенный уровень холестерина в биохимическом анализе крови – довольно частое отклонение, которое далеко не всегда сулит нам атеросклероз и все вытекающие из него последствия: ишемию, инфаркты и инсульты. Но несомненно, если вдруг этот показатель оказался выше нормы несколько раз подряд, это повод задуматься.
Холестерин поступает в организм вместе с пищей (в составе сала, яиц, жирного мяса, куриной кожи, субпродуктов, сливочного масла и т.д) и вырабатывается печенью. Извне к нам попадает лишь порядка 20-25% от суточного количества холестерина. Тогда как печенью синтезируется 75 – 80 %. Как уже отмечалось, не все пищевые липиды вообще содержат холестерин. Например, ни одно из растительных масел не содержит и 1 мг холестерина на литр масла. Таким образом очень умиляют маркетологи, которые в эпоху массовой “холестеринофобии” пишут на этикетках растительного масла “Не содержит холестерина”. Ведь содержать его, оно по определению не может.
Однако наш с Вами организм так или иначе “изготавливает” холестерин из всех липидов (жиров), которые в него поступают. И вот почему. Липиды гидрофобны, т.е в воде они нерастворимы и поэтому не могут самостоятельно циркулировать в нашей крови. Для их транспортировки нужны специальные белки-переносчики – апопротеины.
Комплекс жир + белок (апопротеин) получил название липопротеин (устаревшее – липопротеид). В зависимости от химических и структурных различий в строении транспортируемых жиров (липидов) липопротеины имеют высокую или же низкую плотность. Таким образом, весь жир, циркулирующий в крови, циркулирует только в виде липопротеинов или липопротеидов (липопротеины и липопротеиды это одно и то же смысловое значение), т.е в виде фракций холестерина. В таком виде в нашей крови транспортируются как те жиры, которые содержат холестерин сами по себе (т.е попадают в организм уже в виде липопротеиновых комплексов), так и те, что холестерина не содержат изначально (например, любое растительное масло). Ведь для его транспорта по кровеносной системе, организм его “прицепляет” к апопротеину и получается липопротеин (т.е холестерин).
Сумма всех липидов циркулирующих у человека в крови называется общий холестерин. Он неоднороден и подразделяется на фракции. А именно: липопротеины высокой плотности (ЛПВП), липопротеины низкой плотности (ЛПВП), липопротеины очень низкой плотности (ЛПоНП) и триглицериды.
ЛПНП и ЛПоНП при превышении своих нормальных концентраций, способны откладываться на внутренних стенках сосудов, суживая их просвет и образуя так называемые атеросклеротические бляшки. Это может означать развитие атеросклероза в активной стадии. ЛПНП и ЛПоНП от того ещё называют “вредным” холестерином, это атерогенные фракции. Но ключевым моментом является тот факт, что происходит это лишь в случае воспалительного процесса, который первичен. Но об этом чуть ниже.
ЛПВП наоборот полезен для организма: этот липопротеин “чистит” сосуды, вытягивая с их поверхности мельчайшие молекулы жира, и препятствует образованию холестериновых отложений. Эту фракцию называют “полезным” холестерином.
ЛПВП удаляют избыточный холестерин из клеток органов, тканей и крови, т.е проявляют антиатерогенные свойства. Помимо этого, частицы ЛПВП обладают многими другими положительными характеристиками:
- Их основные белки — АпоА1 и АпоАII — являются эффективными антиоксидантами;
- с ними связан особый фермент параоксоназа 1 (ПОН 1), который блокирует вредный процесс – окисление ЛПНП, расщепляя токсичные окисленные липиды в составе ЛПоНП;
- уменьшая связывание моноцитов крови со стенками артерий, они проявляют противовоспалительные свойства;
- стимулируют движение эндотелиальных клеток;
- блокируют синтез факторов активации тромбоцитов эндотелиальными клетками;
- защищают эритроциты от генерации прокоагулянтной активности, что в результате снижает вероятность образования тромбов;
- стимулируют синтез простациклинов эндотелиальными клетками, продлевая время их жизни (опять-таки это противовоспалительное действие, а также противодействие спазму сосудов);
- уменьшают синтез ДНК в васкулярных гладких мышцах, индуцируемый эпидермальным фактором роста. Если сказать проще, не дают гладкомышечным клеткам сосудов делиться и суживать просвет сосуда;
- имеют тромболитические (растворяющие тромбы) свойства;
- модулируют эндотелиальную функцию, очевидно, за счёт стимулирования продукции оксида азота (NO) – об оксиде азота и его важности тоже будет далее.
Все жиры состоят из жирных кислот и те, в свою очередь, делятся на насыщенные жирные кислоты и ненасыщенные. Ненасыщенные бывают мононенасыщенными и полиненасыщенными. При транспортировке апопротеином, насыщенные жирные кислоты чаще образуют “вредные” фракции холестерина. Тогда как ненасыщенные, особенно полиненасыщенные – транспортируются в виде триглицеридов (соединений с глицерином) либо становятся “полезной” фракцией – ЛПВП.
Таким образом возникает следующая ситуация: львиная доля холестерина вырабатывается печенью и напрямую лишний холестерин “наесть” невозможно, но гастрономические привычки всё же влияют на то, какие жирные кислоты будут транспортироваться в большем количестве.
Также ряд факторов влияет на то, какое количество холестерина будет производить наша печень. Но прямая причинно-следственная связь у развития атеросклероза имеется всё же не со значениями холестерина и его фракций в крови.
Есть и ещё один показатель, который называют коэффициентом (индексом) атерогенности. Атерогенность – это, собственно, склонность холестерина к налипанию на стенку сосудов. Рассчитывается по одной из формул соотношения “полезных” и “вредных” жиров (липидов) в крови. Позволяет с большой долей вероятности оценить вероятность развития сердечно-сосудистых и неврологических осложнений у пациента, уже имеющего атеросклероз. Для лиц, не имеющих атеросклероза на момент сдачи анализа, ценность данного показателя низкая, поскольку не может предоставить информации о рисках начала развития атеросклероза.
В некоторых лабораториях расчёт коэффициента производится автоматически, в некоторых, лаборант либо врач определяют его самостоятельно, на основании значений фракций холестерина в крови больного.
Существуют несколько формул расчёта коэффициента атерогенности (КА).
1) От значений общего холестерина нужно отнять значение ЛПВП и разделить на значение ЛПВП.
2) Суммировать значение ЛПНП и ЛПоНП и разделить на значение ЛПВП.
Уровень холестерина в норме, если коэффициент находится в пределах 2,0 –3,0. В зависимости от реактивов и методов измерения фракций холестерина в конкретной лаборатории, КА может быть в норме 2,2 – 3,5.
Если у больного он в пределах 3,5 – 4,0, то необходим контроль через 6 мес, т.к это пограничное состояние и оно может нести риски прогрессирования атеросклероза в будущем.
Если коэффициент атерогенности выше чем 4,0 – риск высокий.
Значения ниже чем 2,0 – встречаются редко и связаны со стрессами, истощением, изнуряющими физическими нагрузками.
Даже если у вас высокий общий холестерин, но количество “полезной” его фракции тоже высокое, в результате чего коэффициент атерогенности находится в пределах нормы, вам просто нужен контроль состояния и срочно снижать холестерин нет надобности.
В то же время, такая ситуация сигнализирует о том, что в организме что-то не так. У повышения уровня холестерина есть свои причины. К ним перейдём после того, как ознакомимся с тем, почему вообще было решено лечить людей путём снижения холестерина.

Снижение холестерина – откуда пошло и кто это придумал
В 1913 году группа русских учёных во главе с молодым физиологом из Санкт-Петербурга Н.А. Аничковым проводила эксперименты на кроликах, активно скармливая им пищу животного происхождения.
На такой диете растительноядные длинноухие бедолаги прожили меньше положенного, а вскрытие показало, что причиной гибели животных явилась закупорка сосудов, питающих сердце. Отложения на стенках коронарных артерий содержали сгустки жира, холестерина и солей кальция, напоминающие атеросклеротические повреждения сосудов человека. Эти опыты легли в основу “холестериновой” теории, согласно которой, главная причина образования атеросклеротических бляшек это проникновение холестерина в стенку сосуда.
Данная теория завладела умами мировой общественности и породила весьма долгоиграющую и совсем не добрую сказку, до сих пор продолжающую кочевать из одного учебника в другой и даже породившую целый раздел фармакологии.
Тот факт, что сравнивались при этом растительноядные на все 100 % кролики и всеядный человек (а значит сравнение было заведомо некорректным) – никого не смутил. Было это случайным упущением или сознательной ошибкой, мы уже не узнаем. Но в любом случае, порождённая некорректным сравнением и базирующаяся на ошибочных выводах теория стала укореняться.
В какой-то мере, в этом направлении всех подтолкнула медицинская система США. В 1988 году была создана и продолжает щедро финансироваться общенациональная программа США по борьбе с атеросклерозом. Программа включает в себя исследования по биохимии холестерина и по созданию диеты с исключением из пищи жиров, углеводов, соли и холестерина. Стоит ли говорить, что это мало к чему приводит.
Жителям США начали объяснять пользу продуктов, не содержащих холестерина. Даже на бутылках с минеральной водой стали писать: “Не содержит холестерина”. Про растительные масла и говорить не приходится. Было разработано множество диет и диетических продуктов без холестерина, а также лекарств, снижающих концентрацию холестерина в крови. Стремление к бесхолестериновому питанию в США стало почти национальной идеей. Оттуда эта идея начала распространяться в другие страны, подогреваемая фармацевтическими компаниями, производящими лекарственные препараты для снижения уровня холестерина – статины.
Несмотря на то, что прямая связь между количеством холестерина в пище и его концентрацией в крови никогда не была доказана (напротив, неоднократно доказано, что холестерин из пищи и холестерин, накапливающийся в атеросклеротических бляшках, — два совершенно разных холестерина), пропаганда продуктов без холестерина продолжает своё дело, уводя людей от истинных причин проблемы. Не мешают этой пропаганде и данные экспериментов на здоровых добровольцах, которые в течение нескольких месяцев употребляли большие дозы холестерина. Ни у одного из них не было отмечено повышения уровня холестерина в крови и признаков атеросклероза.
Также хорошо известно и широкое распространение атеросклероза в ряде развивающихся стран, население которых недоедает или даже голодает. При голодании, неполноценной, низкобелковой диете в сочетании с физическими перегрузками и эмоциональным перенапряжением атеросклероз развивается чрезвычайно быстро. Это было известно и до того, как по миру начала своё шествие холестеринофобия – по результатам вскрытия тысяч трупов узников фашистских концлагерей. Даже у молодых заключённых, истощённых и не получавших несколько лет с пищей холестерина, регистрировался атеросклероз в тяжёлой форме. Но для бытующей ошибочной парадигмы и коммерчески выгодной холестеринофобии эти факты неудобны, поэтому массовой огласки им, как правило, не придают.
Для того, чтобы понять откуда берутся такие явления, нужно иметь представление о том, какие причины лежат в основе повышения холестерина в крови, а также о причинах возникновения и развития атеросклероза, а затем правильно проложить причинно-следственную связь. Этим и займёмся.

Почему уровень холестерина повышается?
Привожу основные причины в порядке их распространённости.
Причина первая (и самая распространённая) – застой желчи, несвоевременное опорожнение желчного пузыря, изменение состава желчи. Чаще всего бывает при анатомических особенностях желчного пузыря (перегибы и др), но встречается и когда таких особенностей нет. Редкие приёмы пищи – одна из ведущих причин, когда анатомия желчного пузыря не изменена.
Причина вторая (не слишком уступающая первой численно) – снижение функции щитовидной железы (гипотиреоз, в том числе субклинический) или снижение превращения тиреоидных гормонов в активную форму в тканях (тканевой гипотиреоз). Об этой проблеме Вы можете прочесть в моей книге “АИТ и гипотиреоз. Нюансы решают всё!”. Она доступна в виде аудио, в виде электронной книги формата pdf и в виде печатного издания.
Причина третья – нарушение углеводного обмена (сахарный диабет любого типа при его недостаточной компенсации, преддиабет, инсулинорезистентность без сахарного диабета). Главным образом растут ЛПНП и триглицериды. Об инсулинорезистентности можно во всех деталях узнать из моей книги “Инсулинорезистентность. Полные сведения о состоянии и его устранении”. Книга также доступна в виде аудио, в виде электронной книги формата pdf и в виде печатного издания.
Причина четвёртая – организму приходится “латать” повреждения сосудов. Холестерин выполняет функцию лейкопластыря. Чаще всего это бывает при повышении уровня гомоцистеина. Также при злоупотреблении мясными продуктами в условиях дисбиоза кишечника.
Причина пятая – дефицитарные состояния. Дефицит белка/незаменимых аминокислот и ряда витаминов (группа В, особенно В3 – ниацин, вит. Д), Омега-3.
Причина шестая – дисбиоз кишечника. Последние исследования говорят о том, что кишечный микробиом оказывает существенное влияние на липидный профиль и на состояние самих сосудов.
Причина седьмая – синдром уставших надпочечников (СУН).
Причина восьмая – генетическое нарушение (семейные гиперхолестеринемии).
Нередко бывает так, что в одном пациенте сочетается сразу же несколько причин. Само собой, что столкнувшись с проблемой повышенного уровня холестерина, нужно провести комплексное обследование (или как сейчас говорят – чек-ап). Это позволяет найти причины его повышения и далее устранять их. Поскольку повышение уровня холестерина это всегда следствие, устранять нужно в первую очередь причину. Питание и приём добавок сильно различаются в зависимости от причины, которая привела к повышению холестерина. Поэтому браться за коррекцию можно только после поиска тех звеньев, которые нужно корректировать.
Наиболее часто в качестве причины гиперхолестеринемии встречается застой и/или изменение состава желчи, несвоевременное опорожнение желчного пузыря. Это может быть как следствием особенностей строения (загибы, перегибы, перекруты и тд – разные специалисты УЗИ диагностики по разному могут это называть), так и следствием недостатка эссенциальных фосфолипидов, синтеза желчных кислот, дефицита серосодержащих аминокислот (важные составляющие полноценного белка), из которых синтезируется таурин. Из таурина в свою очередь синтезируются желчные кислоты: таурохолевая, таурооксихолевая и тауродезоксихолевая. Эти желчные кислоты наряду с урсодезоксихолевой (её аналогами являются препараты Урсосан, Урсофальк) участвуют в растворении и выведении холестерина, из организма.
Другая, при этом одна из наиболее атерогенных (приводящих к развитию атеросклероза) причин – повышение гомоцистеина. Холестерин в этом случае лишь пытается “залатать” повреждённую стенку сосуда, подобно лейкопластырю.
Далее привожу выдержку из главы своей книги “Повышенный холестерин. Профилактика и лечение атеросклероза”. Эту книгу вы можете у меня приобрести в любой момент как в виде аудио, так и виде электронной книги в pdf формате или в виде печатного издания.
«Среди факторов, повреждающих стенки сосудов, в последнее время в научном сообществе особый акцент делается на гомоцистеин. В 1995 году научный мир потрясло известие о том, что учёные открыли “новый холестерин”. И хотя это соединение впервые описали ещё в 1932 году, а гомоцистеиновая теория атеросклероза возникла ещё в 1969 году, до недавнего времени о гомоцистеине практически не говорили. Однако сегодня трудно найти авторитетное медицинское издание, которое бы не обсуждало важнейшую роль нарушений его метаболизма в развитии сердечно-сосудистых и ряда других заболеваний.
В нашем организме постоянно происходит процесс, который носит название метилирование. От эффективности и состоятельности данного процесса зависит очень многое. Упрощённо это присоединение метильной (–СН-3–) группы к чему-либо. Отсоединение этой группы от чего-либо, называется деметилированием. С пищей к нам постоянно поступает аминокислота метионин – один из главных донаторов (источников) метильных групп. При помощи специальных ферментов, организм отщепляет от него метильные группы и присоединяет туда, где они нужнее всего. Путём метилирования происходит обезвреживание многих экзогенных (попадающих извне) и эндогенных (образующихся внутри организма) токсинов. Также от состоятельного метилирования зависит своевременная переработка гистамина, дофамина, стабильность настроения и многое другое. Но это уже другие истории, нас сейчас интересует именно атеросклеротический процесс. Максимально упрощённо это выглядит так.
В процессе метилирования от молекул метионина отщепились метильные группы и молекулы метионина превратились в промежуточное соединение – молекулы гомоцистеина. Гомоцистеин это невероятно токсичное для клеток нашего организма вещество – эндогенный сильный цитотоксин. Относится к типу очень коварных ядов-аналогов важных веществ. По своему строению он очень похож на сильнейший антиоксидант – аминокислоту цистеин (используемую в медицине даже для защиты от радиации). Всего на одну группу -СН2- его молекула длиннее цистеина, но имеет абсолютно другие свойства. Гомоцистеин, из-за ошибочного распознавания рецепторами, взаимодействует с ферментами вместо цистеина (и, естественно не выполняет необходимые функции цистеина по защите клеток от свободных радикалов). Клетка сосуда уверена, что она надёжно защищена цистеином, и не требует больше себе сильных антиоксидантов. И вот тут-то на неё и набрасываются всяческие свободные радикалы, и грызут клетку, как хотят. К тому же и сам гомоцистеин способен её значительно повреждать.
Главное негативное действие гомоцистеина заключается в том, что он, обладая цитотоксичностью, поражает внутреннюю стенку артерий — интиму, покрытую эндотелием. Образуются разрывы эндотелия, которые организм пытается чем-то заживить. Для такого заживления организм использует холестерин и другие жирные субстанции. Даже очень маленькие количества гомоцистеина могут оказывать достаточно сильное поражающее действие на сосуды. Концентрация этого вещества в крови в 1000 раз меньше, чем концентрация холестерина. При этом повышение его уровня всего на 20–30% может вызвать весьма тяжёлые последствия.
Особенно опасен этот процесс для сердца и сосудистой стенки – эндотелия. Вызывая повреждения в эндотелии сосудов, гомоцистеин “выключает” важный фермент – эндотелиальную NО-синтазу (фермент, производящий NO – оксид азота), что приводит к стойкому сужению просвета сосуда. Длительное повреждение сосудистой стенки молекулами гомоцистеина приводит к воспалению и к появлению микроязв на выстилке сосуда. В результате этого к ней начинают приклеиваться форменные элементы крови, особенно тромбоциты и лимфоциты (из-за миграции к очагу воспаления). Соли кальция тоже не заставляют себя долго ждать, они нередко откладываются там, где есть воспалительный процесс.
Даже если кровяных пластинок – тромбоцитов в крови мало, они всё равно честно выполняют свои функции и заклеивают повреждения, т.к нарушение целостности эндотелия воспринимается специальными рецепторами организма как нарушение целостности сосуда и, соответственно, идёт сигнал о необходимости остановки кровотечения (которого в сущности нет). Если в крови есть излишки холестерина, он тоже устремляется туда, чтобы как лейкопластырь залатать повреждение. Если таковых излишков нет, то они легко могут появиться – печень начнёт производить холестерин с избытком и это всего лишь защитная реакция организма.
Через специальные рецепторы и сигнальные белки, печени будет подаваться команда о том, что нужно произвести много холестерина. Причём, для выполнения функции лейкопластыря больше подходят атерогенные “вредные” фракции холестерина. Они лучше налипают на сосуды и их производство у организма не ограничено, т.к насыщенные жирные кислоты способны производиться даже из углеводов, а производство ненасыщенных существенно затруднено и они могут поступать только извне с пищей.
В результате именно “вредные” фракции и будут производится наряду с повышением холестерина общего. Это важный механизм формирования церебрального, коронарного и прочего атеросклероза, эндартериита (он же облитерирующий тромбангиит), тромбофлебитов. Гомоцистеиновые повреждения постепенно расходуют все антиоксиданты, вызывая ещё больший оксидативный стресс в сосудистых клетках (а значит и новые повреждения, ведущие к воспалению). А в местах холестериновых заплаток это приводит к перекисному окислению ещё и холестерина. И всё это в условиях периодических спазмов сосудов из-за повреждения NO- синтаз и снижения производства важнейшего для сосудов вещества – оксида (окиси) азота (молекула NO).
NO является одной из главных расширяющих просвет сосуда молекул. За открытие этой молекулы в конце 20-го века учёные даже получили Нобелевскую премию.
Устраняя спазмы артерий, NO обеспечивает адекватное снабжение внутренних органов кровью, нормализует кровоток. А значит помогает клеткам тканей снабжаться питательными веществами и кислородом. Кроме того, именно NO препятствует адгезии (прикреплению) тромбоцитов к стенке сосуда, являясь важным компонентом, препятствующим формированию тромбов. Понятно, что снижение производства NO из-за повышения уровня гомоцистеина, ни к чему хорошему не приведёт. Кстати, быстрым донатором NO является известный всем страдающим стенокардией препарат нитроглицерин. Расширяя коронарные (снабжающие сердечную мышцу), сосуды, он восстанавливает баланс между потребностью миокарда в кислороде и притоком крови (и кислорода, который в ней содержится) к клеткам сердца.
В норме, без патологии, процесс метилирования протекает так: метионин отдаёт свои метильные группы (в процессе этого к нему присоединяется аденозин и он становится S-аденозилметионином, который является универсальным детоксикантом). Затем S-аденозилметионин превращается в гомоцистеин и, либо под действием ферментов, зависящих от витамина В6, превращается в цистеин (лишняя -CH-2- присоединяется к аминокислоте серин). Либо под действием фолиевой кислоты (а именно, её активной формы 5-метилтетрагидрофолиевой кислоты) и цианокобаламина (а именно его активных коферментных форм – дибенкозида и метилкобаламина) превращается снова в метионин, способный осуществлять новый цикл детоксикации либо идти на синтез белка мышц, других тканей, креатина. Этот процесс превращения гомоцистеина снова в метионин, носит название реметилирование.
При этом, когда образование нормального цистеина (не промежуточного гомо-) из метионина снижено, то снижен бывает и фосфолипидный синтез в печени, что также повышает атерогенность (фосфолипиды позволяют синтезировать достаточное количество ЛПВП (“полезного” холестерина) и тем самым снижать атерогенность липидов.
Повышение в крови гомоцистеина может возникать из-за врождённых, генетически обусловленных аномалий, называемых полиморфизмами генов фолатного цикла. При этом затруднено превращение витаминов В12 и фолиевой кислоты в их активные формы. И тогда приём аптечных витаминов не подходит, нужны активные формы: метилфолат, метилкобаламин.
Точно такое же повышение уровня гомоцистеина возникает при банальном длительном и сильном дефиците витаминов В6, В12 и фолиевой кислоты (в любом возрасте). Реже при дефиците витамина В2. Также происходит это и с возрастом, т.к запасы данных витаминов, а главное их превращение в высокоактивные коферментные формы, снижаются, а запасы метионина, способного к реакциям, в печени с годами накапливаются. Это приводит к тому, что происходит повреждение сосудов, а уже затем возникает атеросклероз. Более того, вся передовая и истинно научная кардиология уже давным-давно уделяет самое пристальное внимание не столько уровню холестерина и его фракций в крови, сколько уровню гомоцистеина.
Самым главным фактором риска инфаркта считается именно повышенный гомоцистеин, ведь атеросклероз может развиваться как следствие повышенного гомоцистеина. Повышение холестерина в этом случае лишь следствие, при помощи которого, организм пытается справиться с проблемой – “залатать” повреждённые сосуды. Гомоцистеин при этом выступает главным виновником проблемы и прародителем её осложнений. Недостаток активных форм витаминов В6 , В12 и фолиевой кислоты, она же вит. В9 (вследствие низкого потребления или вследствие полиморфизмов генов фолатного цикла) – это самая частая причина повышения уровня гомоцистеина.
Некоторые из причин, приводящих к повышению холестерина, являются по совместительству и основными причинами появления и прогрессирования атеросклероза (например, повышенный гомоцистеин). И атеросклероз будет прогрессировать, если не устранить эти причины, а просто снижать холестерин (например, препаратами группы статинов). Т.е считать атеросклероз следствием повышенного холестерина является в корне неверным. Но верным является утверждение, что и повышение холестерина, и развитие атеросклероза вызывается одной или несколькими из причин, описанных выше.
Семейная гиперхолестеринемия
Пожалуй, наиболее редко встречающаяся и необычная причина это семейная гиперхолестеринемия (СГХС) — наследственная патология, обусловленная мутацией генов. Сопровождается значительным повышением уровня в крови ЛПНП и как следствие, преждевременным развитием и прогрессирующим течением атеросклероза, как правило, в молодом возрасте. Различают гетерозиготную (ген мутантен на одной из парных хромосом) и гомозиготную (ген мутантен на обеих парных хромосомах) СГХС. Уровень общего холестерина (ОХС) у пациентов с гетерозиготной формой СГХС (геСГХС), когда генетический дефект, унаследован от одного из родителей, обычно составляет 7,5-14 ммоль/л. При гомозиготной форме СГХС (гоСГХС), при которой генетический дефект, унаследован от обоих родителей, – 14-26 ммоль/л. Особого внимания заслуживают носители гоСГХС, у которых тяжёлая гиперхолестеринемия приводит к сердечно-сосудистым заболеваниям уже в детстве и юности.
Современная концепция развития атеросклероза, построенная на липидно-инфильтрационной теории (той самой, что берёт своё начало с опытов над кроликами) вполне применима к атеросклерозу у лиц с данными мутациям, поскольку уровень холестерина у них достаточно высок в течение длительного времени. В субэндотелиальное пространство попадает много окисленных ЛПНП. Чем выше уровень ЛПНП в плазме крови, тем интенсивнее протекает этот процесс. А при длительном нахождении ЛПНП в крови вероятность окисления частиц возрастает. Происходит это при СГХС даже в отсутствии всех тех факторов, которые являются причиной повышения холестерина у лиц без СГХС. Развитие атеросклероза, ишемической болезни сердца у больных СГХС значительно ускоряется под действием тех же факторов риска, которые значимы для лиц без СГХС. Среди модифицируемых это: артериальная гипертензия, сахарный диабет, курение, низкая физическая активность, ожирение, гипотиреоз, повышенный уровень гомоцистеина, дефициты веществ.
Немодифицируемые: мужской пол (мужские гормоны сами по себе способны увеличивать риск атеросклероза), возраст, отягощенность семейного анамнеза по сердечно-сосудистым заболеваниям. Все дополнительные факторы риска атеросклероза увеличивают смертность больных при СГХС.
Мутации генов, приводящие к СГХС это, с моей точки зрения, единственное реальное показание к назначению статинов, при условии, что работа с составов желчи, гомоцистеином, тиреоидным статусом, микробиомом, устранением дефицитов, нормализацией углеводного обмена и приёмом наттокиназы и поликосанола не приводит к значительному снижению холестерина. Само собой, что насыщенные жирные кислоты в этом случае есть смысл ограничивать, а вот ненасыщенные нужно употреблять регулярно.
К счастью, какими бы ни были гены, в нашем организме рулит эпигенетика (“надгенетика”, т.е факторы образа жизни) и поэтому работа по всем тем же фронтам, что и в случае повышенного холестерина без СГХС, всё же оказывает в той или иной степени положительный эффект даже при СГХС и статины требуются при ней не всегда.
Снижение уровня холестерина – борьба против своего организма?
Можно долго и упорно бороться со следствием и пытаться снижать холестерин лекарствами группы статинов (которые даже при снижении уровня холестерина в крови не дают достоверного снижения риска инфарктов, ведь причина не устраняется, налипать на повреждённые сосуды может не только холестерин); можно иметь катастрофические последствия гомоцистеинового поражения сосудов в виде инфарктов, тромбозов и ишемических инсультов; можно принимать массу лекарств, снижающих свёртываемость крови. А можно устранить причину (что не отменяет надобности принимать разжижающие кровь лекарства на первых порах). Но нужно понимать, что даже при нормальной или слегка сниженной свёртываемости крови, наличие больших количеств гомоцистеина в ней приводит к тромбозам из-за повреждения сосудов. Если же и свёртываемость крови является повышенной, то риск катастрофы возрастает в десятки раз. Тем не менее, снижать свёртываемость – не панацея, а лишь временное снижение вероятности такой катастрофы.
Разного рода “чистки” сосудов” чесноком по кому-либо тоже не помогут против гомоцистеина. Наш организм это не мусорное ведро, которое периодически нужно освобождать от чего-то. Он способен освобождаться самостоятельно, если у него будет в наличии всё необходимое для обеспечения правильного протекания метаболических реакций.
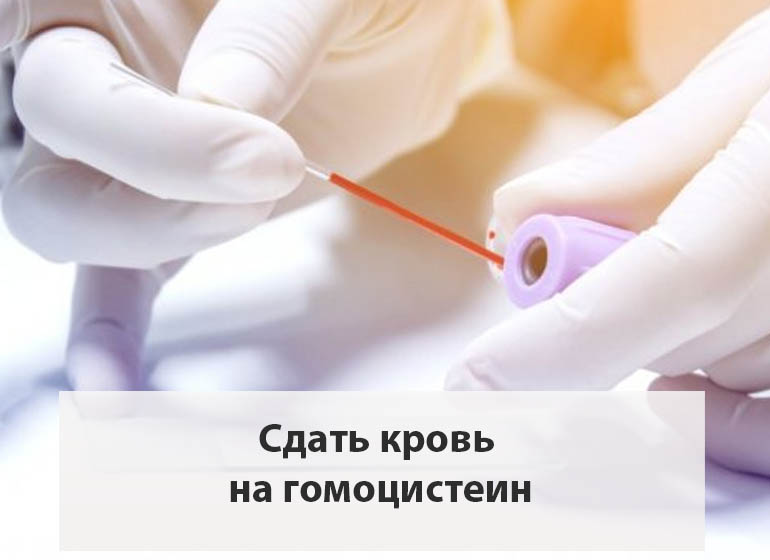
Первое, что нужно делать, причём делать это периодически нужно даже не имея отклонений со стороны сердца и сосудов, а имея таковые и вовсе делать регулярно – хотя-бы 1 раз в год сдавать кровь на содержание гомоцистеина. Имея повышение гомоцистеина, сдавать кровь на гомоцистеин нужно в процессе коррекции витаминами даже чаще, чем на холестерин и его фракции.
Если же у вас уже имеется повышение содержания холестерина в крови, но вы никогда не смотрели гомоцистеин, то сдать кровь на гомоцистеин необходимо хоть завтра. Как таковой нижней границы нормы для него нет, чем он ниже – тем лучше. Оптимально иметь его в пределах 3-6 мкмоль/л. Нормально ниже 7. Содержание между 7 и 9 мкмоль/л это пограничные риски. Если гомоцистеин выше 9 мкмоль/л, то это уже несёт существенные риски для сосудов (вне зависимости от референсов лаборатории). Так, повышение уровня гомоцистеина на 5 мкмоль/л от оптимальных значений, повышает риск развития атеросклероза на 80% у женщин и на 60% у мужчин.
Далее, если у вас он высокий, его необходимо снижать. Если нормальный, но высокий холестерин, то найти и устранить причины повышения холестерина и периодически мониторить и холестерин, и гомоцистеин. Есть нюанс с гомоцистеином ниже 4 мкмоль/л. Снижение может быть нормой, а может служить косвенным сигналом о том, что в организм поступает мало серосодержащих аминокислот (метионина). Для того чтобы подтвердить это или опровергнуть, необходимо проверить общий белок в крови. Если он ниже 75 г/л натощак, значит белка вы недополучаете. Если уровень белка выше чем 75 г/л, то проанализируйте его качественный состав на предмет того, что это за белок.
Достаточно ли вы употребляете мяса, сыра, творога, орехов? В белке этих продуктов больше всего метионина. Увеличив употребление метионина, нужно через два месяца ещё раз сдать кровь на гомоцистеин. Сниженный гомоцистеин не вредит сосудам, но если метионина мало, то может расти холестерин. Ситуация со снижением гомоцистеина и высоким холестерином это почти всегда низкое употребление белка вообще и метионина в частности.
Если же вы при высоком холестерине имеете гомоцистеин выше 7, то получить от меня чек-лист по снижению гомоцистеина можете совершенно бесплатно, написав мне в Инстаграм, или Вконтакте, или же скачав его из моего канала в Телеграм.
Хочется также отметить, что снизить гомоцистеин диетой не получится. Поскольку он является промежуточным соединением, а субстратом для его образования является жизненноважная аминокислота метионин, то при исключении из рациона всех источников метионина пострадают все функции, от него зависящее. Рационально и грамотно это не дать метаболизму метионина застревать на этапе гомоцистеина. А для этого нам нужны метилирующие витамины: В6, фолиевая кислота и В12. Лучше в их активных формах. Режим дозирования подбирается индивидуально на основании анамнеза и уровня гомоцистеина.
Почему кровеносные сосуды естественным образом сжимаются и затвердевают с возрастом, повышая риск сердечно-сосудистых заболеваний?
Свежее исследование Колорадского университета в Боулдере (CU Boulder) выявило нового удивительного виновника этого процесса – и он находится в кишечнике. «Это первое исследование, которое показало, что изменения в микробиоме кишечника при старении оказывают неблагоприятное влияние на здоровье сосудов», – говорит ведущий автор Вена Брант (Vienna Brunt), научный сотрудник отделения интегративной физиологии. «Это открывает целый путь потенциальных новейших вмешательств для предотвращения сердечно-сосудистых заболеваний».
Дуглас Силс и Вена Брант подчеркивают, что они абсолютно не предлагают людям использовать антибиотики в качестве сердечно-сосудистого источника молодости. «Мы использовали антибиотики исключительно в качестве экспериментального инструмента. Существует слишком много побочных эффектов и других проблем с их широким использованием», – сказал Брант. Но они верят, что диеты с высоким содержанием пробиотической ферментируемой пищи (йогурт, кефир, кимчи) и пищевых волокон могут сыграть роль в профилактике сердечных заболеваний, способствуя здоровому кишечному микробиому.
Недавно они запустили исследование на людях, чтобы выяснить, как различные диеты влияют на кишечник и, в свою очередь, риск сердечно-сосудистых заболеваний. Они также изучают соединение под названием диметилбутанол, содержащееся в некоторых оливковых маслах, уксусах и красных винах, которое блокирует бактериальный фермент, необходимый для производства ТМАО. В конечном счёте, это может быть развито в новую эффективную пищевую добавку. Как отмечается в редакционной заметке, сопровождающей статью об описанных выше результатах научной работы в Journal of Physiology, наряду с исследованиями, связывающими стареющий микробиом с желудочно-кишечным, иммунным и мозговым старением, новое исследование предлагает ещё один повод для поддержания здоровья наших кишечных бактерий – здоровье сердечно-сосудистой системы. Как говорят редакторы: «Источник здоровья и молодости на самом деле может лежать в кишечнике».

Дисбиоз кишечника.
Как показывают наиболее актуальные исследования, в деле профилактики и лечения атеросклероза особо пристальное внимание необходимо уделить как ни странно кишечнику, а именно – его микробиому (микрофлоре). Сохранить сердце и сосуды здоровыми можно, если держать под контролем желудочно-кишечную микрофлору, в т.ч. путём коррекции питания, где обязательно должны присутствовать пищевые волокна (далее будет рассказано причём тут они, какой миф есть вокруг них и как всё обстоит на самом деле). Немаловажно сохранять и норму по бифидобактериям, которые среди дружественной флоры нашего кишечника занимают в среднем порядка 80 % (от 60 % до 90 %). Всё это следует из ряда исследований, посвящённых взаимосвязи между микрофлорой и риском ССЗ.
Микрофлора помогает переваривать пищу и тем самым активно вмешивается в обмен веществ в нашем организме. Благодаря этому она влияет и на состояние сосудов, и на уровень липидов в крови. Через продукты расщепления разных веществ, бактерии могут оказывать влияние на все системы организма.
Ухудшение состояния сосудов часто начинается с бактерий, перерабатывающих холин и карнитин нашей пищи в ТМА. Задуматься о возможной связи L-карнитина с развитием атеросклероза заставило открытие 2011 года, показавшее связь метаболизма холина – структурного аналога L-карнитина – с патогенезом сердечно-сосудистых заболеваний.
Главным источником холина служит фосфатидилхолин – одна из самых распространённых молекул клеточных мембран, в больших количествах содержащаяся в пище животного происхождения (не стоит путать с фосфатидилхолином подсолнечного и соевого происхождения, который мы можем принимать отдельно в виде препаратов или БАДов эссенциальных фосфолипидов – он работает несколько иначе и не перерабатывается в ТМА так масштабно. Однако при нарушенном микробиоме он может вызывать диарею).
Триметиламин (ТМА) – органическое соединение, третичный амин. В организме человека приём определённых продуктов (чаще животного происхождения, например, красного мяса, яичного желтка), содержащих лецитин, холин и L-карнитин (или приём больших доз добавок, содержащих холин или L-карнитин), обеспечивает определённых представителей микрофлоры кишечника субстратом для синтеза ТМА, который затем всасывается в кровоток. Высокие уровни триметиламина в организме связаны с развитием триметиламинурии, или синдрома запаха рыбы. Раньше врачи запрещали людям с высоким сосудистым риском употреблять яичные желтки и объяснялось это наличием холестерина в составе желтка. Затем теория избытка холестерина, поступающего извне, с треском провалилась и доказана не была (как мы помним, 75 – 80 % от циркулирующего в крови холестерина всегда синтезируется нашей печенью).
Однако употребление желтков куриных яиц не следует считать полностью безвредным – они содержат много холина и балластных насыщенных жирных кислот: стеариновой и пальмитиновой. Последняя усиливает имеющиеся воспалительные процессы и проявляет атерогенный эффект. А холин, как оказалось, используется некоторыми кишечными бактериями для синтеза триметиламина (ТМА). В свою очередь, ТМА быстро абсорбируется и окисляется ферментами семейства FMO (флавинмонооксигеназа, FMO3 – главный фермент процесса) в печени до триметиламин N-оксида (ТМАО), вызывающего развитие атеросклероза. В ответ на это печень синтезирует холестерин, чтобы защититься и процесс становится похож на тот, что описан в разделе о гомоцистеине. Не стоит считать холин как таковой вредным, т.к это жизненно необходимое витаминоподобное вещество (в линейке витаминов группы В обозначается как В4. Холин необходим для работы нервной системы, печени и является структурным компонентом клеточных мембран). Также важно обеспечивать адекватное потребление холина во время беременности (450 мг/день).
Имеется взаимосвязь между составом пищи, состоянием кишечной микрофлоры и образованием полезных и вредных для сердечно-сосудистой системы веществ. В частности, при наличии достаточного количества пищевых волокон в рационе, здоровая кишечная микробиота продуцирует много полезных метаболитов, трансформирует желчные кислоты, синтезирует короткоцепочечные жирные кислоты, которые улучшают сосудистый тонус через сигнальные рецепторы, а также поставляют энергию для кишечника (субстраты для питания эпителия ЖКТ) и оказывают противовоспалительное действие.
При наличии же большого количества пищи, содержащей много холина и карнитина, особенно в случае дисбиозов, в организме происходят нежелательные процессы. В частности, происходит воспаление кишечника, усиливается его проницаемость, увеличивается количество вторичных желчных кислот, которые меняют хронотропизм и инотропизм (ритм и силу сокращения сердца), а также вызывают воспаления и фиброз. В это же время из холина и карнитина кишечная микробиота производит много ТМА (триметиламина) – предшественника ТМАО, который образуется в печени и, в свою очередь, может вызывать атеросклероз, коронарный тромбоз, неблагоприятные видоизменения в сердце, а также почечную недостаточность.
Кишечный микробиом.
Микрофлора является важнейшим фактором регулирования атеросклеротических процессов. Микроэкологические нарушения в организме человека следует считать значимыми пусковыми механизмами нарушений липидного обмена.
Применение пробиотических микроорганизмов оправдано и при таком механизме развития атеросклероза, который связан с патологией сосудистой стенки, имеющей химическую или иммунологическую природу возникновения. Обладая явными детоксицирующими и иммунотропными свойствами, пробиотики снижают подобные риски поражения артерий. Более того, риск разрывов эндотелия артерий (которые организм “залечивает” холестерином) из-за цитотоксического действия гомоцистеина можно заметно минимизировать, используя витаминсинтезирующие свойства определенных бактерий.
В отсутствие необходимого количества витамина В12 и фолиевой кислоты количество гомоцистеина резко возрастает. Поэтому применение, например, концентратов пропионовокислых бактерий (мощнейших продуцентов кобаламина) и продуктов на их основе, которые обеспечивают организм легкоусвояемыми формами витаминов В12 и В9, способствует эффективной утилизации гомоцистеина и в перспективе могут помогать восполнять необходимые витамины без приёма этих витаминов извне.
Стоит отметить, что поддержание кишечного микробиома в норме способствует реальному снижению сердечно-сосудистого риска. Так, например, исследование экспертов университета Ноттингема и Королевского колледжа Лондона в 2018 г. показало, что у всех женщин существует значительная корреляция (взаимосвязь) между разнообразием микробов в кишечнике и здоровьем артерий. После коррекции метаболических изменений и артериального давления показатель жёсткости артерий был выше у женщин с меньшим разнообразием здоровых бактерий в кишечнике. Также, в других исследованиях было показано, что с возрастом микробиота кишечника начинает производить токсичные молекулы, включая ТМАО (триметиламиноксид), которые попадают в кровоток, вызывают воспаление, окислительный стресс и повреждают ткани сосудов. При этом, ТМАО, показанный в ранних исследованиях, был связан с повышенным риском атеросклероза, инфаркта и инсульта.
Таким образом, все результаты доказывают, что поиск диетических мер воздействия для обеспечения здоровых бактерий в кишечнике может быть использован для достоверного снижения риска сердечных заболеваний. У меня есть свой фаворит среди пробиотиков, в своём блоге я с радостью делюсь этой информацией.

Клетчатка и холестерин.
Теперь внесу ясность в отношении пищевых волокон (клетчатки).
Некоторые люди уверены, что пищевые волокна снижают холестерин просто приводя к выведению того холестерина, который мы едим (поэтому те, кто знают, что холестерин мы никогда не “наедаем” извне напрямую, не верят в пользу пищевых волокон). На деле клетчатка работает несколько иначе.
Известно, что пищевые волокна способны снижать уровень холестерина в крови при смешивании с желчными кислотами в кишечнике, тем самым предотвращая абсорбцию, того холестерина, который произведён печенью. В дальнейшем пищевые волокна вместе с жирными кислотами выводятся из организма.
Вследствие усиленного синтеза в печени новых желчных кислот происходит дополнительное снижение уровня холестерина в крови (он расходуется на синтез желчных кислот). Кроме того, пищевые волокна создают обширную дополнительную поверхность, помимо, поверхности слизистой кишечника, к которой фиксируются бактерии. После адгезии на пищевые волокна в течение короткого времени осуществляется формирование микроколоний, а в последующем биоплёнки, вследствие чего возрастает метаболическая, в том числе и холестеринметаболизирующая активность микробиоты.
Тот факт, что пищевые волокна, согласно клиническим наблюдениям оказывают благоприятный эффект при самых разнообразных заболеваниях, доказывает что на неперевариваемых волокнах в первую очередь фиксируются те микроорганизмы, которые определяют оптимальную кишечную экологию для хозяина. Поэтому при разработке эффективных продуктов, способных снижать уровень холестерина в крови, целесообразно использование пробиотических микроорганизмов в комплексе с натуральными пребиотическими компонентами. Например, натуральные овощи и различные виды клетчатки с Айхерб в зависимости от индивидуальных особенностей организма пойдут на пользу.
Если Ваша цель в том, чтобы реально снизить сердечно-сосудистые риски и прожить долгую счастливую жизнь, начинать необходимо с выяснения причин, вызвавших гиперхолестеринемию именно в Вашем организме. Далее необходимо устранить причины, в т.ч через модификацию образа жизни, а это как мы видим, намного шире и увлекательнее, чем банальное и бесполезное “не ешьте жирное”.
Продолжение материала в статье “Холестерин VS Статины. Часть 2“.
Читайте также по теме:

Органические маркировки продуктов питания
Вам также может понравиться

Экологически чистое питание: особенный подход к организации питания
13.08.2018
Ведущее экопредприятие Европы Alnatura и её глава Гётц Рейн
24.01.2021

4 комментария
Nastya
Спасибо за материал, жду вторую часть! Отправила почитать родителям, они как раз лечат статинами плохой холестерин.
Михаил
Очень развернутая статья! Сразу заставляет задуматься и пересмотреть свое мнение в данном вопросе! Я и не думал, что в этой теме столько подводных камней!
Марина
У меня всегда были проблемы с холестерином, который я лечила статинами. Теперь я знаю, что проблема намного глубже, и не все так просто в лечении. Спасибо за статью!
Анастасия
В России ещё много проблем с сердечно-сосудистыми заболеваниями по той простой причине, что их никто не лечит. Все врачи стараются устранить симптомы и уложиться в нормативы анализов. Только настоящие лекари будут искать первопричину!